对小鼠进行基因敲除是研究目的基因功能的常用方法。传统的、从受精卵或胚胎时期进行基因操作,来获得基因敲除小鼠的方法往往耗时长达几年。AAV(腺相关病毒)递送系统结合CRISPR/Cas9可以实现对成年小鼠的基因敲除,从而大大缩短获得基因敲除小鼠的时间。AAV还具有低免疫原性、不同血清型实现靶向不同组织或器官的优点。
与此同时,AAV递送系统有一个固有缺陷,其载体所能容纳的插入序列最大只有4.7Kb。使用CRISPR/Cas9进行基因敲除,需要将含有Cas9编码序列和sgRNA的载体进行递送。然而,Streptococcus pyogenes (SpCas9) 和 gRNA together就占了4.2kb,对AAV的容量产生了挑战。因此,如何对Cas9进行有效的递送一直是CRISPR/Cas9在动物体内发挥作用的难点。过去的方法包括:在不同物种中寻找序列更短更有效的Cas9、将Cas9分段表达在两个AAV载体等。
北大王晓伟课题组于2021年9月在STAR Protocols杂志发表了一篇文章记录一种结合了Cre-LoxP和CRISPR/Cas9、用AAV递送,实现对成年小鼠进行组织特异性基因敲除的方法。
原理大致为:
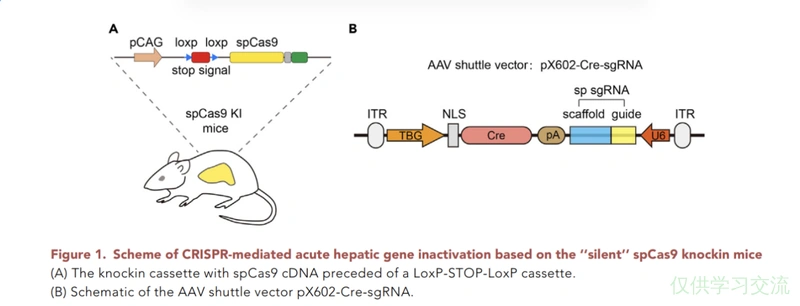
将panel A所示的片段整合入野生小鼠,panel B所示片段用AAV递送。对于不同的靶基因来说,左边的小鼠都是用的同一种,但是B中的序列可以根据需要自定义。以图示为例,TBG是肝脏特异性启动子,AAV感染小鼠后,Cre酶只在肝脏中表达,在小鼠的肝脏中删去两个loxp包裹的stop signal,spCas9得以表达,与Cre一同转导入动物的还有sgRNA,于是实现在肝脏中对该sgRNA靶向的片段进行切割。spCas9后面还接了GFP方便实验者观察Cre酶是否成功发挥作用。
该方法的优点有:
- 把Cas9从载体上拯救下来,相当于给AAV扩容了,可以加更长的组织特异启动子或其他有特殊目的的元件。
- GFP对Cre酶的活性进行了可视化。
- 有个这样的小鼠也许会更方便吧。(比如相比于传统方法不用为每个基因单独构建flox小鼠了,当然因为没有同源重组过程,用途也局限了)
原文链接:
参考博文:
鸣谢:小龙哥