关于小分子蛋白在 12% TG 胶中的分离
实验背景(2025.8.29)
- 样品:K562 细胞裂解液,目标检测 γ-H2AX (~14 kDa)。
- 电泳条件:12% Tris-Glycine SDS-PAGE,常规电压。
- 观察:分子量标记(marker)中,大分子(>40 kDa)在分离胶上很快就展开分离,而 10 kDa 与 15 kDa 的条带一直到接近胶底时才彼此拉开。
现象总结
- 在 12% TG 胶体系中,小分子(10–15 kDa)迁移几乎紧跟溴酚蓝前沿,很晚才真正被“筛开”;
- 对比之下,中大分子蛋白(40–70 kDa)在分离胶上段就能获得清晰分离。
机制理解
- Tris-Glycine 体系中,离子前沿效应决定了蛋白最初的“堆积—解堆积”过程。
- 对 <20 kDa 的蛋白,分离胶孔径仍然偏大 → 在大部分迁移过程中筛分效应不强;
- 同时 Gly 在 pH 8.8 下迁移速度加快,小蛋白迁移率接近离子前沿 → 长时间几乎不分开,直到跑到胶底才展现差异。
经验结论
同时应控制电压与温度,避免前沿过快推进导致小分子“跟着溴酚蓝一起跑”。
12% TG 胶并不适合分辨 10–15 kDa 的蛋白,这会导致 γ-H2AX 等小分子目标在靠近胶底才分离,分辨率有限。
若目标蛋白 <20 kDa,推荐使用:
Tris-Tricine SDS-PAGE(16–16.5%) 或
Bis-Tris + MES 体系 或
高浓度/梯度 TG 胶(15–16.5% 或 4–20%)。
可重复性问题
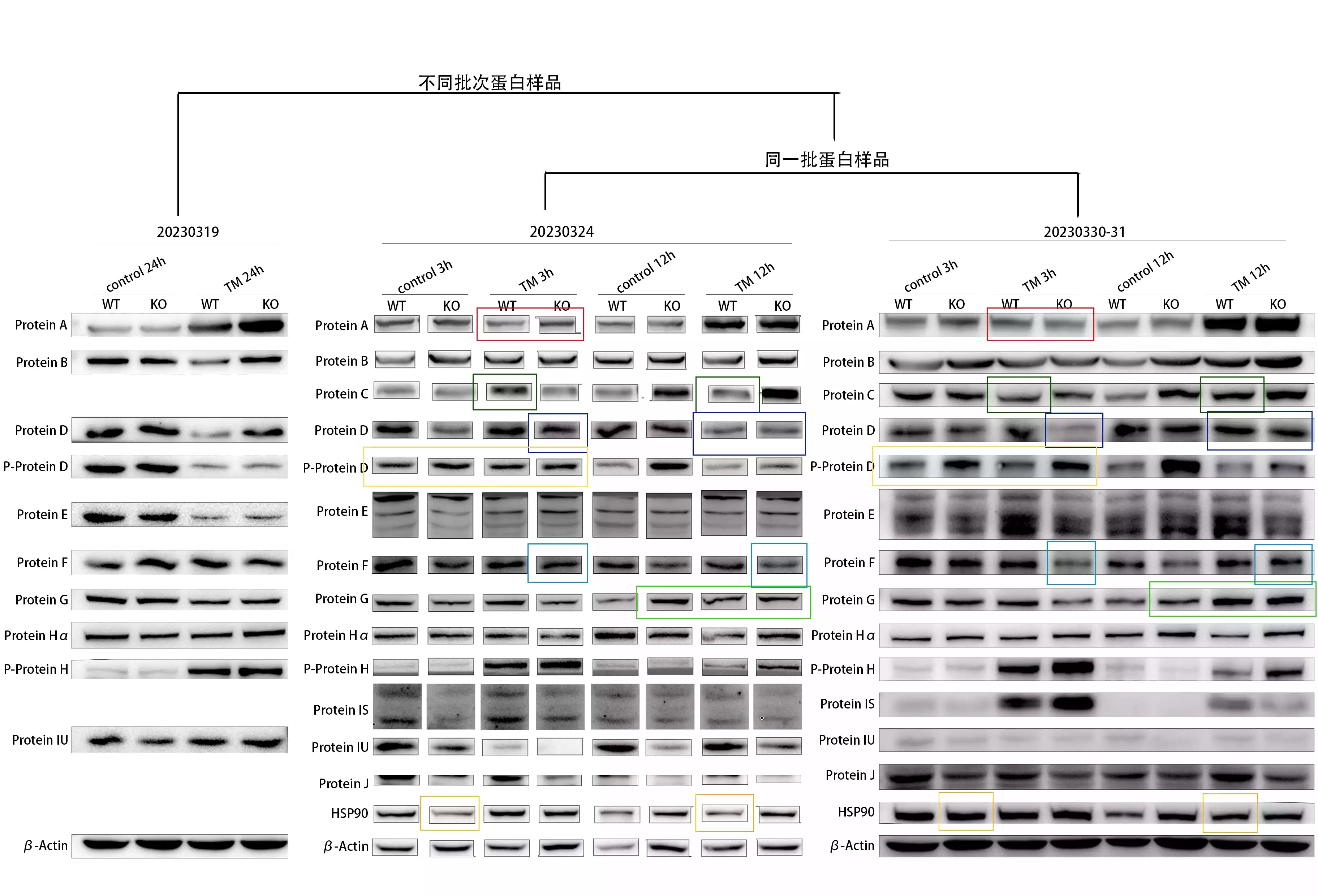
永远不要相信单次WB的实验结果,也不要对着结果过度分析,在重复三次以上之前。这次正好有个WT和KO样品搞反了的事故,所以用完全一样的样品又跑了一次,结果把两次的结果放在一起对比,发现对照之间的不少条带相对亮度在两次实验中是完全相反的,即下图中框框框起来的部分。
信号整体偏弱时的结果不可信
之前我用过的内参有beta-actin和beta-tubulin,这次打卡了HSP90。
我这个月第一次跑的时候,遇到了actin不齐的问题,蛋白样品已经用BCA法定量过了。但是遇到了同一拨样品、相同的上样量的三次平行重复中actin条带的相对亮度均不一致的问题。后来换了一个别的牌子的抗体,就每次都天然内参一致了。可能是第一次用的那个抗体要么回收次数过多、要么本身就不行。浪费了我整整三次完整的WB耗费的时间。
之后的WB我都直接用两个内参去跑了,同时孵anti-actin和anti-HSP90。回头想想,对于actin这种商业化抗体,且蛋白本身表达量高,应该1s就能曝出很亮的条带才对,当我第一次WB显影时发现曝光30s以上才出现那样微弱的条带时,就应该立刻意识到抗体出问题了,而不是用这个根本不可信的数据去无意义地调整上样量。

另外,我倾向于认为,当WB信号整体非常低时,比较两个泳道的相对条带亮度差异是极其不准确的,如第一张图中Protein A被框起来的条带,在两次重复实验中的相对亮度完全相反。
抗体选择问题
抗体不好不要找自己的问题,上面那个actin是一个例子,对于不常用蛋白,抗体本身就不行的可能很大。比如Protein I有IS和IU两种形式,用抗体一就只能得到IU形式,得不到IS形式,而用抗体二可以得到IS形式,可是IU条带就要弱得多。关键是,这两家抗体的说明书都写了能砸到两种形式的条带。

显色液问题
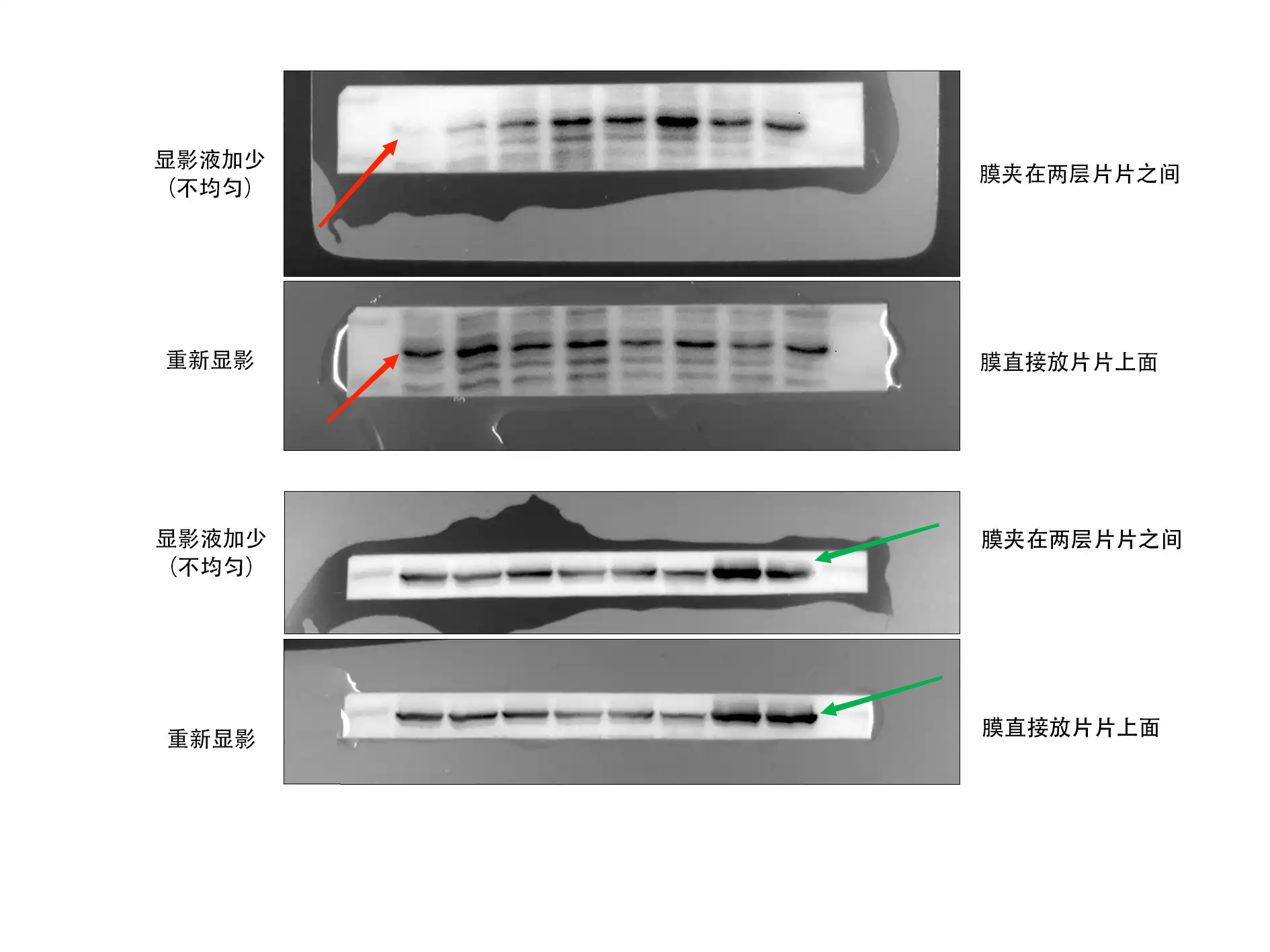
我有次曝出来这样一张图,最初是以为没有洗干净。比如洗膜时TBST加的太少,所以膜中间部分洗得不充分,导致中间比较脏而两侧干净。后来我发现其实只是我的显色液覆盖的不够均匀。这个小细节太重要了,它可能直接影响不同泳道之间的条带亮度差异。以后加显色液时,一定要左右晃动或用平板压片等方法把显色液加均匀。
曝光时间长短问题
你看这个HSP90,光看曝光1s,3s,10s的图,一看就内参不齐,要重新做。但是再一看曝光30s的,好像也不是那么不齐……你说这算不算造假呢?

抗体剥离问题
之前没尝试过这种方法。我用的碧云天的一抗二抗剥离液,效果不是很高,剥离完后显影条带确实弱了很多,但整张膜曝光出来都是黑色了。所以这个方法挺多自己排除错误等用途的时候自己看一看,不可能生产正式展示的图片,因为它剥离不干净的。

比如这张膜剥离后,用相同二抗重新孵育完又把原来的条带显示出来了。

上面被剪掉一半的是二次孵育的抗体,下面的清晰条带是剥离过的抗体,因为所使用的二抗相同所以又显示出来了
见过肖老师实验室一个师兄用过另一个牌子的抗体剥离液,他说原理是还原性成分。我看他剥离完之后那个膜在自然光下都成半透明的了。不过显影后确实很干净,什么条带都没有。可惜我忘记问是哪个公司的了。以及二次孵育抗体时,可以尽量选用不同二抗,来防止剥离过的抗体再现。
杂带影响主带时切膜
众所周知WB的预测大小和实际观察到的大小是有差异的,甚至可能差异很大。
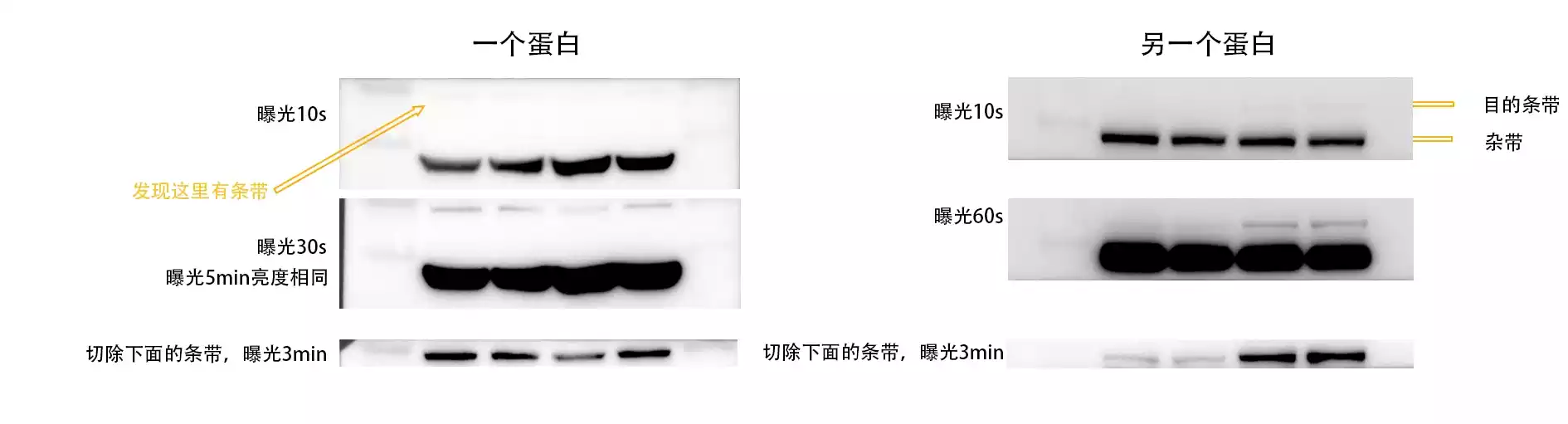
我用anti-PDI(UPR途径中的蛋白)抗体一直以为它的实际大小小于预计大小,直到有一次二抗孵育了特别久,在这条带的上方出现了一条微弱的条带,而这条带的大小跟预计大小更接近。所以究竟哪一条才是PDI蛋白的条带呢?
也许只有Knockout大法才能真正不留悬念的解决这个问题,虽然这太麻烦了。
想要得到较亮的条带的话,需要把发光太强的干扰条带给切掉,不然曝光很久可能都爆不出来。
考马斯亮蓝染色
碧云天有个考马斯亮蓝染色液,非常好用快速。一个小时内可以看到清晰的条带。直接用水脱色。
配胶问题
4%~12%梯度预制胶YYDS,用配套的Running buffer可以恒压170V半个小时跑到底,而且条带清晰。梳子孔很深,据说可以每孔放40微升样品。美中不足是第一条和最后一条泳道略微有丢丢慢,所以跑成一个微弱的笑脸(我用的1.0mm 12孔胶)。
转膜问题
湿转的时候一定是“冰水浴”而不是“冰浴”,后者的冷却效果远远小于前者。所以加完冰之后继续加水到接近槽子顶部的位置。
有人会重复使用转膜液,在相同恒流下,新鲜的转膜液的电压会更高,转膜速度也会更快。
转膜时间不要太长(尤其在高电流的情况下),我先试了用恒流300mA转2h20min,冰浴,结果转完温度挺高的,而且膜严重脱水,出现了很多较大的气泡,转膜结果可想而知,Marker都哭歪了。后来,试了用恒流250mA转1h30min,冰水浴,转完效果就很好,膜还是湿湿的bia在滤纸上的状态。
样本处理问题
丽姐有次告诉我膜蛋白不能煮,煮了会聚团。不过我问其他做膜蛋白的人也没有说不能煮。
处理时间长短问题
如第一张图所示,之前超过24h的衣霉素处理在WT和KO之间一点差异都看不到。然后重新翻看文献的时间,设置了3h和16h处理组,结果16h没啥差异,3h有差异。算是切身体会到时间参数的重要性,以后要引以为戒。首先参考文献,如果文献查不到,自己也要设置覆盖度大一点的time-couse,比如x秒、x分、1h、3h、12h、24h等。这次就很险,如果没有重新做3h的组,可能就直接相信这个实验中没有差异了,导致错过了重要的现象。
细胞和组织样本差异问题
- 用衣霉素处理小鼠,取肝组织提蛋白
- 从小鼠肝脏分离肝原代细胞,衣霉素处理肝原代细胞,提蛋白
- 用肝脏来源细胞系,衣霉素处理,提蛋白
这三个结果可以天差地别。