本文是网上各种资料东抄抄西抄抄整理的,为了省事就不一一对应地列出处了,参考链接统一在文末。
前言
构建基因敲除小鼠,是观察某基因在哺乳动物中的缺失引起何种表型、继而分析基因功能,或人为破坏干扰已知功能来达到一些研究目的的常用手段。相比于在细胞中进行基因敲除,小鼠因个体数量少、有性繁殖、养育周期长等特点,所使用的技术流程要更复杂。
根据是否在小鼠的所有细胞中敲除基因,可以分为
- 完全性基因敲除:获得全身所有的组织和细胞中都不表达该基因的小鼠模型。
- 条件性基因敲除:在特定的组织或细胞中敲除该基因,而该基因在其它组织或细胞表达正常。
二者的实现原理均为利用“同源重组”原理。将目的基因用一段外源DNA序列(多采用筛选基因新霉素)替代,就获得在整个发育时期的全身所有组织和细胞中都不表达该基因的小鼠模型,即完全性基因敲除。条件性基因敲除的实现除了基于“同源重组”,还依赖Cre-loxP重组酶系统。
- loxP: 全称locus of X-over P1,来源于噬菌体P1。是一段长度为34bp的DNA序列,包括两个13bp的反向重复序列和一个不对称的8bp间隔区组成。反向重复序列是Cre重组酶的特异识别位点,而间隔区域决定了loxP位点的方向。(ATAACTTCGTATA – NNNTANNN -TATACGAAGTTAT)
- Cre: 一种位点特异性的DNA重组酶,能特异识别loxp位点,介导loxp位点间的序列删除或重组。
Cre重组酶识别loxP位点两端的反向重复序列并结合形成二聚体,然后此二聚体与另一个loxP位点上的二聚体结合形成一个四聚体。LoxP位点是有方向性的,四聚体连接的两个位点在方向上是平行的。然后两个loxP位点间的DNA序列被Cre重组酶切断。接着,DNA连接酶快速高效地将这些链连接起来。重组的结果取决于loxP位点的位置和方向。 主要会发生以下三种情况: 1、 如果两个loxP位点位于同一条DNA链上且方向相同,Cre重组酶介导loxP间的序列切除; 2、如果两个loxP位点位于同一条DNA链上且方向相反,Cre重组酶介导loxP间的序列反转; 3、如果两个loxP位点位于不同的DNA链或染色体上,Cre重组酶介导两条DNA链发生交换或染色体易位。
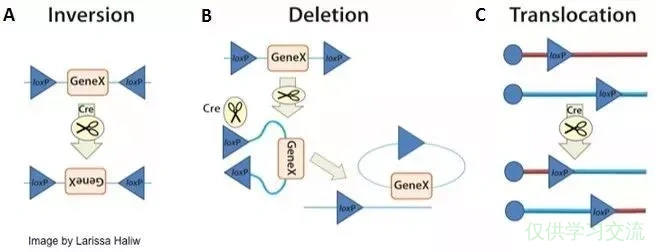
在构建条件性基因敲除鼠时,通常将编码Cre酶的基因和带有loxP位点的基因放在不同的老鼠上(二者分别称为Cre小鼠和flox小鼠),然后通过杂交的方法让它们在子代中相遇,将Cre酶的coding region连在特定组织中表达的组织特异性启动子下,就实现了只在该组织中敲除loxP位点之间的DNA序列的目的。
条件性敲除相比于完全性敲除的优点至少包括:
- 可以研究基因在某个特定组织中的作用
- 使研究缺失会造成胚胎致死或幼年死亡的基因成为可能
从实现技术来看,基因敲除小鼠(flox小鼠)的构建方法可以分为
- 构建一个具有“敲除盒”的质粒(带有目的片段两翼的同源臂、抗性基因、loxP位点等),质粒进入细胞后,按照预期目的,两个同源臂之间的片段将会替换掉染色体上原来的片段
- 用电穿孔等方法把质粒转入受体ES细胞内
- 用选择培养基筛选抗药ES细胞,并利用PCR或Southern Blotting等方法鉴定是否正确发生同源重组
- 将中靶ES细胞注射到受体囊胚中,将注射后存活的胚胎移植到假孕小鼠子宫中,让其受孕。
- 小鼠出生后,通过观察毛色是否嵌合和嵌合程度判断是否获得嵌合体小鼠。
囊胚腔中有很多ES细胞,我们注射进去的也是ES细胞,为了区分,通常使用不同毛色的ES细胞和供体囊胚。这样,如果小鼠毛色中出现了ES细胞的毛色,说明嵌合成功。注意区分嵌合体和杂合子,杂合子是同源染色体上的两个等位基因不同,嵌合子是全身上下的那么多细胞分别来源于不同背景的ES细胞。嵌合体不能直接拿来做实验,被称为F0代小鼠。将F0与野生型小鼠杂交,通过对子代PCR鉴定F0中的中靶基因是否具有生殖系遗传能力。这样获得的是杂合子F1代小鼠。之后根据实验目的继续杂交得到纯合敲除小鼠或连续回交(一般是10代)来纯化遗传背景。
CRISPR/Cas9打靶的过程:
- 针对基因组特异序列设计向导RNA (gRNA)
- 体外转录gRNA以及编码Cas9蛋白的mRNA
- 将gRNA, Cas9 mRNA注射到小鼠受精卵中
- 注射后的受精卵移植到假孕母鼠输卵管中,受精卵发育成F0代小鼠
如果不在受精卵中额外注射含有同源臂的基因替换盒,只是让DNA在被Cas9切割后依靠非同源末端修复,这样就是全身敲除。虽然是在受精卵(1细胞期)注射的,但是这个方法仍然可能得到嵌合体。因为Cas9发挥作用有时间上的延后,可能在2细胞期或4细胞期才开始切割DNA,或者虽然还未到2细胞期,但DNA复制已经开始,就可能造成靶基因的突变类型在不同后代细胞中不同。
如果在受精卵中额外注射含有同源臂的基因替换盒,那就可以通过同源末端修复引入两翼有loxP site的DNA片段,构建flox小鼠,从而用于条件性基因敲除。
ES打靶和CRISPR/Cas9打靶的对比:
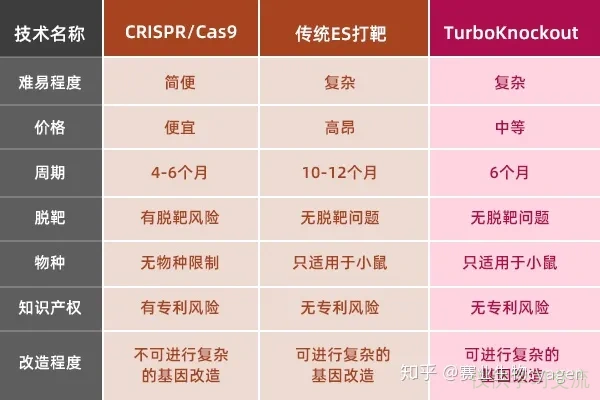
(第三列那个TurboKnockout是赛业生物开发的另一个方法,本文先不提。依靠非同源末端修复方式的转基因(Transgenic)小鼠因为基因的插入方式或突变类型并不单一,所以可能表型也会有差异。而依靠同源重组方式的Knock-in或Knock-out小鼠的Genotype是完全一致的。)
Cre-loxP并不是唯一的重组酶系统,FLP-FRT系统是与Cre-loxP类似的重组酶系统。Cre-loxP从噬菌体中发现,FLP-FRT从酿酒酵母中发现。
- FLP: flippase(FLP) recombinase, 识别一对FRT位点之间的DNA序列
- FRT: FLP recombinase target,类比loxP site
Knockout-First策略
Knockout-First策略是一种结合了Cre-loxP和FLP-FRT的小鼠基因敲除策略。它的基因替换盒的核心区域长下面这样:
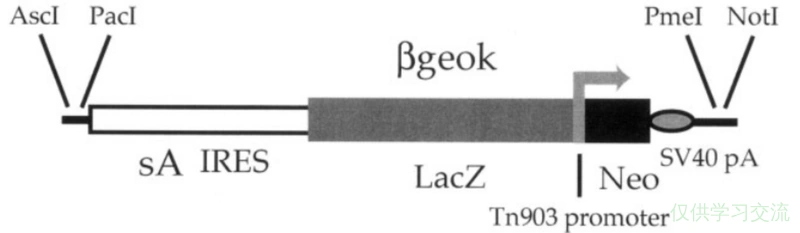
sA, splice acceptor element; IRES, internal ribosomal entry site; lacZ, gene encoding β-galactosidase; neo, neomycin phosphotransferase; pA, SV40 polyadenylation signal
把这个序列插入基因内部的内含子,splice acceptor element就会在剪接时截获这条mRNA,使它拼接到这段序列上。IRES是内部核糖体进入位点,使LacZ和Neo可以正常翻译。之后的SV40 polyA signal使转录到这里时终止,于是插入序列后面的后半段基因就不会表达了。因为依赖的是人为改变剪接方式,整段基因的表达依然是在靶基因启动子的控制下的,在Neo前插入Tn903 promoter,可能是为了应对靶基因本身表达量低时,Neo仍可以作为筛选标记被正常表达。
可以看到,只要这段序列被插入到靶基因内部,即便靶基因的所有外显子仍然是完整的,它的表达仍然被破坏了。因此,Knock-First可以实现完全性基因敲除。而在上述核心元件的基础上,借助Cre-loxP和FLP-FRT,它同时也可以转换为条件性基因敲除。
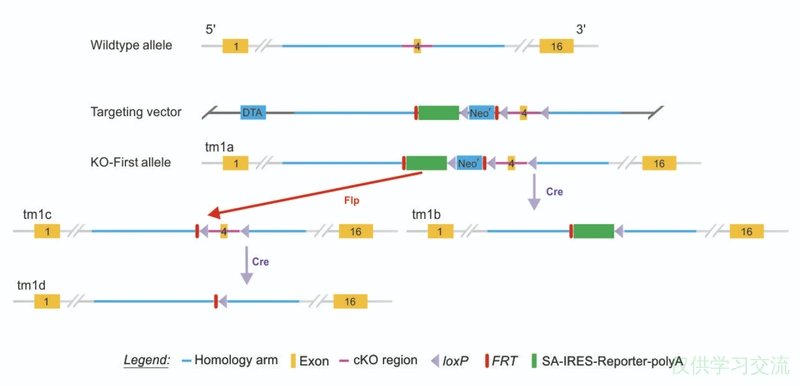
如图,Targeting vector是需要构建的基因替换盒,通过两段“homology arm”和Wildtype allele进行同源重组,就得到KO-First allele(tm1a)。此时,由于绿色方框表示的SA-IRES-Reporter-polyA,这条allele上的靶基因已经被敲除,所以这个技术被叫做“Knockout-First”(相对于传统构建Flox小鼠的“Conditional-First”)。而在核心元件内部和周围按照图示,插入了2个FRT位点和3个loxP位点。
此时有两种情况,如果先和Flp小鼠杂交,2个FRT之间的部分被删除,完全性敲除的tm1a变成条件性敲除的tm1c,在没有Cre酶时,tm1c上的靶基因是正常表达的,当遇到Cre时,tm1c上的2个loxP位点之间的序列被删除,成为靶基因敲除的tm1d。而如果tm1a先因与Cre小鼠杂交,3个loxP位点之间的序列直接被删除,就变成tm1b,tm1b上的靶基因也直接被敲除。
KO-First Alleles: Generic Mutation Information
| ** Mutation** | Allele | Description | Conditional Potential |
|---|---|---|---|
| tm1a | Knockout-First(KO-First) | Reporter-tagged insertion allele (Null) | Yes |
| tm1b | CREed KO-First | Reporter-tagged deletion allele (for IMPC) | No |
| tm1c | FLPed KO-First | Conditional ready (restored gene activity) | Yes |
| tm1d | FLPed, CREed KO-First | Deletion allele, no reporter (Null) | No |
根据实验目的的需要,可以对KO-First小鼠进行不同的杂交策略来达到不同目的,既可以完全性敲除,也可以通过FLP重组转变为条件性敲除,实现一鼠多用。
下面举一个利用knockout-first的具体例子,假设我们需要利用KO-First策略构建基因X的条件性基因敲除小鼠,需要如何构建KO-First小鼠和设计后续的杂交实验呢?
- 已知敲除基因X的Exon2可以使其功能失活,所以我们据此构建好了包围Exon2的KO-First Targeting Vector。
 (promoter和promoterless的不同用途我还没搞清楚)
(promoter和promoterless的不同用途我还没搞清楚) - 选择来源于C57BL/6N小鼠的ES细胞系JM8.N4,毛色是黑色。将Targeting Vector显微注射到若干ES细胞中,加药筛选。筛到的ES细胞扩增培养,并用PCR鉴定是否成功中靶。
- 将成功中靶的ES细胞注射到供体囊胚中(毛色棕色),将处理后的囊胚手术放入假孕雌鼠的子宫。让它生,得到嵌合体小鼠(F0)。
- 通过毛色嵌合情况,选择黑色嵌合度高的小鼠,与野生型的背景小鼠C57BL/6N杂交。
 理想情况下,F1会是下图所示的杂合子。
理想情况下,F1会是下图所示的杂合子。 因为嵌合鼠中ES细胞来源的KO-First allele可能进入生殖系细胞,也可能没有进入,所以需要对F1小鼠进行基因型鉴定(genotyping)。
因为嵌合鼠中ES细胞来源的KO-First allele可能进入生殖系细胞,也可能没有进入,所以需要对F1小鼠进行基因型鉴定(genotyping)。 - 我们想要构建的是Cre控制的条件性基因敲除小鼠,所以需要通过FLP将tm1a转变为tm1c。将F1杂合子与纯合的FLP小鼠杂交。这样,我们有1/2的概率得到下面的F2小鼠。
 另外1/2是wt/wt,所以仍然需要genotyping,确定两条allele中一条是tm1c,一条是WT。由于Knockout first allele中frt间删除序列较长,并且Flp删除效率的限制,在第一代获得的条件性敲除小鼠(tm1c+/-,Flp+/-)中,可能会出现tm1a allele。由于在这一代小鼠中,每个细胞中都在发生Flp对Frt序列的识别和切割过程,无法保证每个细胞(尤其是生殖细胞)中的目的序列都完全被删除。建议第一代获得的条件性敲除小鼠先与野生型小鼠交配一代,获得tm1c+/-且不含FLPeR(Flp wt/wt)后再进行后续的交配。这样,新产生的子代从受精卵时期就是靶序列完全删除的基因型,从这个受精卵发育而来的所有细胞都是完全删除靶序列的“干净”的基因型。
另外1/2是wt/wt,所以仍然需要genotyping,确定两条allele中一条是tm1c,一条是WT。由于Knockout first allele中frt间删除序列较长,并且Flp删除效率的限制,在第一代获得的条件性敲除小鼠(tm1c+/-,Flp+/-)中,可能会出现tm1a allele。由于在这一代小鼠中,每个细胞中都在发生Flp对Frt序列的识别和切割过程,无法保证每个细胞(尤其是生殖细胞)中的目的序列都完全被删除。建议第一代获得的条件性敲除小鼠先与野生型小鼠交配一代,获得tm1c+/-且不含FLPeR(Flp wt/wt)后再进行后续的交配。这样,新产生的子代从受精卵时期就是靶序列完全删除的基因型,从这个受精卵发育而来的所有细胞都是完全删除靶序列的“干净”的基因型。 - 这样我们就得到了flox小鼠的杂合子F2(flox/+)。F2自交,后代有1/4概率得到纯合的flox小鼠F3(flox/flox)。综上,从嵌合体F0出发,经过三代杂交,我们就能得到靶基因的纯合flox小鼠【F1(tm1a/wt), F2(tm1c/wt), F3(tm1c/tm1c)】。
 上图使用了与ES细胞(BN背景)不同背景的FLP小鼠C57BL/6J(简称BJ),如果后续我们想利用遗传背景为BJ的小鼠进行实验,就需要在F2代与野生型BJ“回交”来纯化背景,一般认为回交10代以上可以得到纯净的遗传背景。在已经确定生殖遗传的情况下,可以直接将嵌合鼠与FLPeR交配,这个交配策略可以节约1个月左右。
上图使用了与ES细胞(BN背景)不同背景的FLP小鼠C57BL/6J(简称BJ),如果后续我们想利用遗传背景为BJ的小鼠进行实验,就需要在F2代与野生型BJ“回交”来纯化背景,一般认为回交10代以上可以得到纯净的遗传背景。在已经确定生殖遗传的情况下,可以直接将嵌合鼠与FLPeR交配,这个交配策略可以节约1个月左右。
- 得到纯合flox小鼠后,与Cre鼠杂交得到KO鼠。KO鼠鉴定:

注释
小鼠品系的命名
名词解释
小鼠基础知识你知道多少?什么是近交系小鼠?哨兵鼠呢?回交和杂交?|南模生物 (modelorg.com)
药物控制的条件性触发Cre
loxP sites的设计原则
- 在内含子区域,两个loxP site之间包一个或几个起重要功能的Exon
- 两个loxP site尽可能近,以便更好地被Cre重组
思考:
- 被Cre重组出去的DNA的后路是什么?
- loxP sites能设计在外显子区域吗?
- Cre发挥作用后,能诱导mRNA decay吗?(师兄的qPCR结果确实低了)
参考材料:
- 【小鼠大学问】小鼠基因编辑神器
- CRISPR/Cas9和ES打靶孰优孰劣?怎样选择才是最优解?
- 【干货】Cre-loxP重组酶系统介绍
- 真没想到,用了『它』不到1个月就拿到了基因敲除小鼠!
- The Cre-lox and FLP-FRT systems
- KO-First: A Tool for Studying Gene Function Across the Mammalian Genome
- 赛业生物写的KO-First流程